Tính chất hóa học của Nitơ? Cấu tạo phân tử của Nitơ. Tính chất vật lý của Nitơ. Ứng dụng và điều chế của nó. Dưới đây, Kovacova sẽ mách bạn tất tần tật về các thông tin cần biết về hợp chất hóa học mang tên Nitơ này nhé!
Tính chất hóa học của Nitơ
Cấu tạo phân tử
- Nhóm VA có cấu hình electron ngoài cùng là: ns2np3.
- Nên vừa phát hiện được tính oxh và tính khử.
- Cấu hình electron của N2: 1s22s22p3.
- CTCT: N ≡ N.
- CTPT: N2.
- Số oxh của N2: -3, 0, +1, +2, +3, +4, +5.

Cấu tạo phân tử
Thuộc tính vật lý
- Là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí (d = 28/29), hóa lỏng ở -196 ºC.
- Nitơ ít tan trong nước, hoá lỏng và hoá rắn ở nhiệt độ rất thấp. Không duy trì sự cháy và sự hô hấp (không độc).
Tính chất hóa học của Nitơ
- Nitơ có những số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
- N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
- Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
- Nitơ triệu chứng tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
Tính chất hóa học của Nitơ – Tính oxi hoá
Phân tử nitơ có kết liên ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
Công dụng với hidro
Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
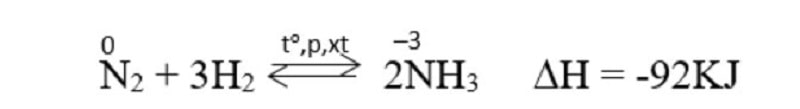 Tác dụng với kim loại
Tác dụng với kim loại
- Ở nhiệt độ thường nitơ chỉ Công dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
- Ở nhiệt độ cao, nitơ Tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý: những nitrua dễ bị thủy phân tạo NH3.
Nitơ biểu hiện tính oxi hoá khi Công dụng với nguyên tố có độ âm điện nhỏ hơn.
Tính chất hóa học của Nitơ – Tính khử
Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
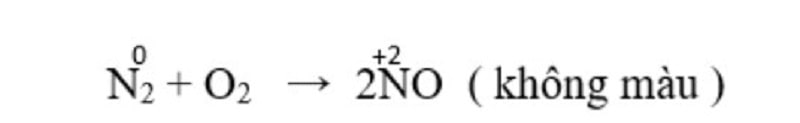
Ở điều kiện thường, nitơ monoxit Công dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
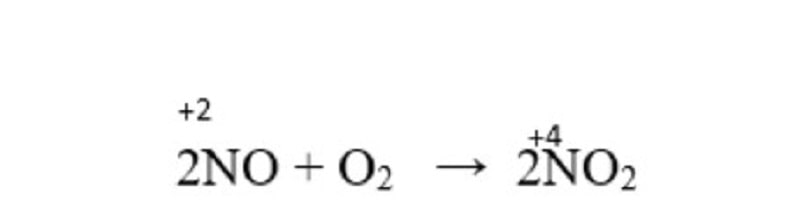
Nitơ xuất hiện tính khử khi Tác dụng với nhân tố có độ âm điện rộng rãi hơn.
– Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Ghi nhớ: Nitơ biểu hiện tính khử khi Tác dụng với những yếu tố có độ âm điện to hơn. thể hiện tính oxi hóa khi Tác dụng với các yếu tố có độ âm điện lớn hơn.
Trạng thái tự nhiên
Trong thiên nhiên, nito tồn tại ở dạng tự do và dạng hợp chất.
- Ở dạng tự do, nito chiếm 80% thể tích không khí.
- Ở dạng hợp chất, nito có nhiều trong khoáng chất NaNO3 có tên là diêm tiêu natri.
Ngoài ra nito có trong thành phần của protein, axit ucleic, … và nhiều hợp chất hữu khác.
Ứng dụng và điều chế
Ứng dụng
– Nitơ là thành phần dinh dưỡng chính của thực vật.
– Tổng hợp amoniac để điều chế phân đạm, axit nitric …
– Được dùng làm môi trường trơ trong công nghiệp.
– Nitơ lỏng được dùng để bảo quản máu và những mẫu sinh học khác.
Điều chế
Trong công nghiệp
Chưng cất phân đoạn không khí lỏng, thu nitơ ở -196 ºC, vận chuyển trong các bình thép, nén dưới áp suất 150 at.
Trong phòng thí nghiệm
Đun dung dịch bão hòa muối amoni nitrit (Hỗn hợp NaNO2 và NH4Cl):
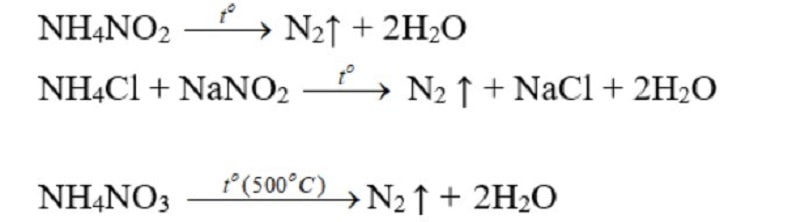
Như vậy, Kovacova đã giải đáp cho bạn về Tính chất hóa học của Nitơ. Hy vọng với những chia sẻ trong bài viết này sẽ giúp bạn có thêm những thông tin hữu ích và áp dụng vào trong thực tế nhé!