Tính chất hóa học của HNO3? HNO3 là gì? Cấu tạo phân tử HNO3? Tính chất vật lý của HNO3? Điều chế và ứng dụng của nó. Cùng tham khảo ngay trong bài viết này để lưu ngay cho mình những kiến thức hữu ích về vấn đề này nhé!
Tính chất hóa học của HNO3
HNO3 là gì?
HNO3 hay còn gọi là Axit nitric, được gọi là dung dịch nitrat hidro hay còn được gọi là axit nitric khan. Axit này được hình thành ở trong tự nhiên, tạo ra từ các cơn mưa do sấm và sét tạo thành.
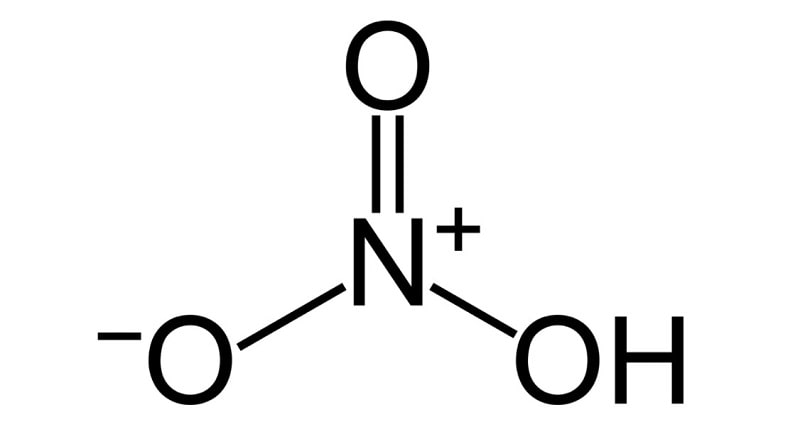
Cấu tạo phân tử HNO3
Đối với cac chất hóa học đều có riêng cho mình từng cấu tạo phân tử riêng và HNO3 cũng vậy. Cùng tìm hiểu về cấu tạo phân từ của nó qua hình ảnh dưới đây nhé!

Cấu tạo phân tử HNO3
Tính chất vật lý của axit nitric
- Axit nitric là chất lỏng không màu, tan tốt trong nước (C<65%). Nó cũng có khả năng tồn tại ở dạng khí, không màu. Trong môi trường tự nhiên, axit nitric có màu vàng nhạt do sự tàng trữ của oxit nito.
- Axit nitric trong sáng có tỷ trọng khoảng 1522kg/m3, khi để ngoài không khí, nếu axit nitric có nồng độ 86% ta sẽ thấy khói trắng bốc lên. Nhiệt độ đông đặc là -42 °C và nhiệt độ sôi là 83 °C.
- Dưới Công dụng của ánh sáng, axit nitric bị phân hủy tạo thành nito dioxit NO2 ( nhiệt độ thường).
4HNO3 → 4NO2 + 2H2O + O2
- Thành ra cần bảo quản axit nitric trong các chai, lọ tối màu, tránh ánh sáng và diện tích cất giữ phải đảm bảo nhiệt độ thấp hơn 0 °C.
- Ở nhiệt độ cao, nito dioxit bị hòa tan bởi axit nitric thành dung dịch có màu vàng hoặc đỏ. Điều này gây tác động không nhỏ đến các đặc trưng vật lý, phụ thuộc vào nồng độ NO2 , đặc biệt là áp suất hơi trên chất lỏng, nhiệt độ sôi, màu sắc dung dịch.
- Chưng cất hỗn tạp axit nitric và nước, ta được azeotrope có nồng độ 68% HNO3 và sôi ở 120.5 °C, 1 atm. Axit nitric là một axit có tính ăn mòn cao, cực độc, dễ bắt lửa.
Tính chất hóa học của HNO3
Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có khả năng nitrat hóa nhiều hợp chất vô sinh, có hằng số cân bằng axit (pKa) = −2.
Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có thuộc tính của một axit thông thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành những muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric Công dụng với kim loại: Công dụng với hầu hết những kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim khí + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim khí + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Tính chất hóa học của HNO3
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim khí được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Công dụng với phi kim (các nhân tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Công dụng với oxit bazo, bazo, muối mà kim khí trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không Công dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có thể phá hủy nhiều hợp chất hữu cơ, nên sẽ rất hiểm nguy nếu để axit này tiếp xúc với cơ thể người.
Điều chế HNO3
Trong tự nhiên, axit nitric được tạo ra từ các cơn mưa rộng rãi có sét, gây nên các trận mưa axit.
Điều chế HNO3 trong phòng thử nghiệm
Người ta cho muối natri nitrat tinh thể Tác dụng với axit sunfuric đặc, chưng cất hổ lốn này tại nhiệt độ sôi của axit nitric là 83 °C cho đến khi còn lại chất kết tinh màu trắng. Tuy nhiên, phương pháp này chỉ tạo ra một lượng nhỏ axit.
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Axit nitric bốc khói đỏ thu được có thể chuyển thành axit nitric màu trắng. Khi thực hiện thể nghiệm , các dụng cụ phải làm từ thủy tinh, đặc biệt là bình cổ cong nguyên khối do axit nitric khan.
Điều chế HNO3 trong công nghiệp
Axit nitric loãng có thể cô đặc đến 68% axit với một hổ lốn azeotropic với 32% nước. Để thu được axit có nồng độ cao hơn, tiến hành chưng cất với axit sunfuric H2SO4. H2SO4 đóng vai trò là chất khử sẽ hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thường có nồng độ 52% và 68%. Việc sản xuất axit nitric được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald phát minh.
Ứng dụng của HNO3
Trong phòng thí nghiệm
Axit nitric được sử dụng làm thuốc thử liên can tới clorit. Cho axit nitric Tác dụng với mẫu thử, sau đó cho dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc clorua. Ngoài ra, nó cũng dùng để điều chế muối nitrat.

Ứng dụng của HNO3
Trong công nghiệp
- Axit nitric 68% được sử dụng để chế tạo thuốc nổ bao gồm nitroglycerin, trinitrotoluen (TNT) và cyclotrimethylenetrinitramin (RDX), và các loại phân bón chứa nito như phân đạm một lá nitrat amoni NH4NO3, những muối nitrat như KNO3 , Ca(NO3)2 ,…
- Axit nitric có nồng độ 0,5-2% được sử dụng làm hợp chất nền nhằm quyết định trong dung dịch có tồn tại kim khí không. Người ta gọi đó là kỹ thuật ICP-MS và ICP-AES. Cần sử dụng axit nitric tinh khiết hoàn toàn vì có một số lượng các ion kim khí nhỏ có khả năng gây ảnh hưởng tới kết quả phân tách.
- Do axit nitric phản ứng với hầu hết những kim loại trong những hợp chất hữu cơ nên nó được dụng trong ngành luyện kim, xi mạ và tinh lọc. Khi cho axit này phối hợp với axit clorua, ta được dung dịch nước cường toan có khả năng hòa tan bạch kim và vàng.
- Sử dụng axit nitric để sản xuất các chất hữu cơ, bột màu, sơn, thuốc nhuộm vải.
- Dùng làm thuốc tẩy màu- colorometric test, giúp phân biệt heroin và morphine.
- Axit nitric được dùng để sản xuất nitrobenzen – tiền chất để sản xuất anilin và các dẫn xuất anilin với các ứng dụng chủ chốt trong sản xuất bọt xốp polyuretan, sợi aramit và dược phẩm.
- Axit nitric cũng là hợp chất trung gian dùng trong sản xuất bọt xốp polyuretan mềm và các sản phẩm polyuretan khác, tỉ dụ các chất kết dính, những chất bịt kín, các chất bọc phủ và những chất đàn hồi, đi từ vật liệu toluen diisoxyanat.
- Dùng làm chất tẩy rửa các đường ống, bề mặt kim loại trong những nhà máy sữa. Axit nitric được dùng để loại bỏ những tạp chất, hòa đồng lại độ tiêu chuẩn của nước. Một trong các ứng dụng khác cho IWFNA là một chất oxy hóa trong nhiên liệu lỏng hoả tiễn.
Mức độ nguy hiểm khi sử dụng HNO3
Những vết thương khi tiếp xúc HNO3
- Hít phải: Làm tổn hại hệ hô hấp, có khả năng khiến phổi bị sưng.
- Nuốt phải: Khiến khoảng trống miệng, họng, thực quản, dạ dày bị bỏng, gây nguy hiểm tới tính mệnh. Nhẹ sẽ gây nôn ói, ỉa chảy. Nặng có khả năng khiến tuần hoàn máu bị rối loạn, gây tử vong.
- Dây vào mắt: Làm tổn thương giác mạc, có khả năng dẫn tới mù lòa.
- Tiếp xúc với da: Gây phỏng da.
- Phơi nhiễm lâu có khả năng dẫn tới ung thư.
- Khi làm việc với axit nitric cần mang đồ dùng bảo hộ cần lao an toàn.

Mức độ nguy hiểm khi sử dụng HNO3
Biện pháp xử lý sự cố do axit nitric gây ra
Axit bắn vào mắt: ngay tức khắc dùng nước sạch để rửa mắt, phối hợp nháy mắt trong 15 phút. Sau đó dùng muối natri clorua 0.9% để rửa lại rồi đưa tới cơ sở y tế để được điều trị tiếp.
Axit xúc tiếp với da: Lột bỏ áo xống bị dính axit, sử dụng khăn khô lau tổn thương rồi sử dụng nước sạch (dùng xà phòng nếu có) để rửa lại nhiều lần. Đưa nạn nhân tới cơ sở y tế để điều trị tiếp.
Hít phải hơi axit nitric: di chuyển nạn nhân ra khoảng không thoáng khí, ủ ấm. Để nạn nhân nằm lặng rồi giao thông với cơ sở y tế gần nhất.
Nuốt phải axit nitric: Hòa tan MgO với nước hoặc sữa với tròng trắng trứng rồi đưa tới cơ sở y tế gần đó để điều trị.
Hỏa hoạn xảy ra do axit nitric: Sử dụng bột khô, bình khí cacbon dioxit để dập lửa. Sử dụng dung dịch kiềm để trung hòa axit. vận động những thùng chứa, hoặc dùng nước để làm nguội những thùng này tránh trường hợp phát nổ.
Trường hợp axit nitric bị tràn, rò rỉ: Sử dụng cát, đất để phủ lên chỗ axit tràn ra. Sau đó dùng Ca(OH)2 hoặc soda khan để trung hòa. Dùng nước làm sạch khoảng không hóa chất bị rò rỉ.
Lưu ý khi sử dụng HNO3
- Axit nitric là chất oxy hóa mạnh, khi Tác dụng với cyanit, bột kim có thể phát nổ và tự bốc cháy khi phản ứng với turpentine.
- Ở nồng độ đậm đặc, nó gây bỏng da do phản ứng với protein keratin, khiến da chuyển sang màu vàng. Khi được trung hòa sẽ chuyển thành màu cam.
- Có thể phản ứng mạnh với kim loại tạo thành khí hydro dễ cháy trong không khí.
- Khi pha loãng, tuyệt đối không được đổ nước vào axit mà phải cho axit vào nước.
- Sử dụng những thùng chứa bằng nhựa thay cho kim loại vì axit nitric không Tác dụng với chất liệu này.
- Những thùng chứa phải đậy nắp kín, tránh ánh nắng mặt trời.
- Khoảng trống lưu trữ phải thoáng mát, tránh xa các nguồn nhiệt.
- Nền nhà phải chống được axit.
Như vậy, Kovacova đã giải đáp cho bạn về tính chất hóa học của HNO3. Hy vọng với những chia sẻ về tính chất hóa học của hợp chất này và một số thông tin khác sẽ giúp bạn có thêm những thông tin hữu ích nhé!
Xem thêm: