Tính chất hóa học của Amoniac? Amoniac là hợp chất được ứng dụng rất nhiều trong hóa học và nó xuất hiện trong đời sống hàng ngày của chúng ta. Tuy nhiên, để nó về tính chất hóa học của hợp chất này thì không phải ai cũng biết.
Dưới đây, Kovacova sẽ giải đáp cho bạn về vấn đề này nhé!
Tính chất hóa học của Amoniac
Cấu tạo phân tử của Amoniac
Amoniac là gì? Amoniac NH3 là hợp chất trong phân tử có 1 nguyên tử Nitơ ở đỉnh liên kết cộng hoá trị với 3 nguyên tử Hidro ở đáy tam giác.
Cấu tạo phân tử amoniac:
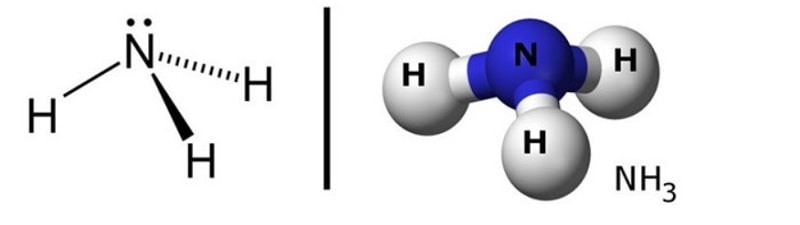
Cấu tạo phân tử của amoniac
Tính chất vật lý của Amoniac
Là chất khí không màu, mùi khai và xốc.
Khí NH3 tan rất nhiều trong nước: 1 lít nước ở 800C có thể hòa tan 800 lít khí NH3. Amoniac là chất tan trong nước tạo thành dung dịch amoniac. Dung dịch amoniac đậm đặc có nồng độ 25%.
Tính chất hoá học của Amoniac
Tính chất hóa học của Amoniac – Tính bazơ yếu
Nguyên nhân: do cặp e chưa tham gia liên kết ở nguyên tử N
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
Tính chất hóa học của Amoniac – Tính bazơ yếu
Amoniac phản ứng với nước (NH3 + H2O)
NH3 + H2O ↔ NH4+ + OH–
⇒ Dung dịch NH3 làm cho quỳ tím chuyển màu xanh, phenolphtalein không màu chuyển màu hồng.
Amoniac phản ứng với Axit → Muối Amoni
• PTPƯ: NH3 + HCl và NH3 + H2SO4
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Amoniac phản ứng với dung dịch muối của những kim loại mà hidroxit không tan → bazơ và muối
• PTPƯ: NH3 + Muối dd → Bazơ + Muối
2NH3 + MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)3](OH)2 (xanh thẫm)
– Khi NH3 dư thì:
CuSO4 + 4NH3 → [Cu(NH3)3]SO4
Tính chất hóa học của Amoniac – Tính khử mạnh
Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
- Amoniac Tác dụng với O2 (NH3 + O2)
- Amoniac Tác dụng với Cl2 (NH3 + Cl2)
- Amoniac Công dụng với oxit của kim khí
Điều chế và Ứng dụng của Amoniac
Điều chế Amoniac
- Trong công nghiệp: tổng hợp từ N2 và H2
N2 + 3H2 ↔ 2NH3 (4500C; Fe, p)
- Trong phòng thí nghiệm:
◊ Cho muối amoni Công dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
◊ Nhiệt phân muối amoni
NH4Cl → 3 + HCl (nhiệt độ)
NH4HCO3 → 3 + H2O + CO2 (nhiệt độ)
Cách nhận diện Amoniac
- Khí không màu có mùi khai.
- Khí làm cho quỳ tím chuyển màu xanh hoặc làm cho phenolphtalein không màu chuyển màu hồng.
- Tạo khói trắng với HCl đặc.
Ứng dụng của Amoniac
- Sản xuất axit nitric, những loại phân đạm; điều chế hiđrazin làm nhiên liệu cho hoả tiễn.
- Amoniac lỏng được dùng làm chất gây lạnh trong máy lạnh.
Như vậy, Kovacova đã giải đáp cho bạn về Tính chất hóa học của Amoniac. Hy vọng với những chia sẻ trong bài viết này sẽ giúp bạn có thêm những thông tin hữu ích cho mình nhé!
Xem thêm: