Tính chất hóa học của oxit axit bazơ muối? Để học tốt được môn hoá, những em cần đặc biệt ghi nhớ thuộc tính hoá học của những nhân tố và các hợp chất.
Bài viết dưới đây của Kovacova sẽ giúp bạn hệ thống lại kiến thức về vấn đề này nhé!
Tính chất hóa học của oxit axit bazơ muối

Tính chất hóa học của oxit axit bazơ muối
Tính chất hoá học của Oxit bazơ
Oxit bazơ Công dụng với nước H2O
– Một số Oxit bazo Tác dụng với nước tạo thành dung dịch bazo (kiềm)
PTPƯ: Oxit bazo + H2O → Bazo
Ví dụ: BaO(r) + H2O(dd) → Ba(OH)2,(dd)
Na2O + H2O(dd) → 2NaOH
CaO + H2O(dd) → Ca(OH)2
– Một số oxit bazo khác Công dụng với nước như: K2O, Li2O, Rb2O, Cs2O, SrO,…
Oxit bazo Công dụng với Axit
– Oxit bazo Tác dụng với axit tạo thành muối và nước
PTPƯ: Oxit bazo + Axit → Muối + H2O
Ví dụ: CuO(r) + HCl(dd) → CuCl2,dd + H2O
BaO + 2HCl → BaCl2 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Oxit bazo Tác dụng với Oxit axit
– Một số oxit bazo (là những oxit bazo tan trong nước) Tác dụng với oxit axit tạo thành muối
PTPƯ: Oxit bazo + Oxit axit → Muối
Ví dụ: CaO + CO2 → CaCO3
BaO + CO2 → BaCO3
Tính chất hoá học của Oxit axit
Oxit axit Tác dụng với nước H2O
– Nhiều Oxit axit Tác dụng với nước tạo thành dung dịch axit
PTPƯ: Oxit axit + H2O → Axit
Ví dụ: P2O5 (r) + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
– các oxit axit Tác dụng được với nước và bởi thế cũng tan trong nước.
Oxit axit Tác dụng với bazo
– Oxit axit Tác dụng với bazo tạo thành muối và nước
PTPƯ: Oxit axit + Bazơ → Muối + H2O
Ví dụ: CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ba(OH)2 → BaSO3 + H2O
Oxit axit Tác dụng với oxit bazơ
– Oxit axit Công dụng với một số oxit bazơ (tan) tạo thành muối.
Ví dụ: CO2 + BaO → BaCO3
Tính chất hoá học của Axit
Axit làm đổi màu giấy quỳ tím
– Dung dịch axit làm đổi màu giấy quỳ tím thành đỏ
Axit Tác dụng với kim khí
+ Axit Công dụng với kim khí tạo thành muối và giải phóng khí Hyđro H2
PTPƯ: Axit + kim loại → Muối + H2↑
+ Điều kiện diễn ra phản ứng:
– Axit: thường dùng là HCl, H2SO4 loãng (nếu là H2SO4 đặc thì không giải phóng H2; nội dung này sẽ học ở bậc THPT)
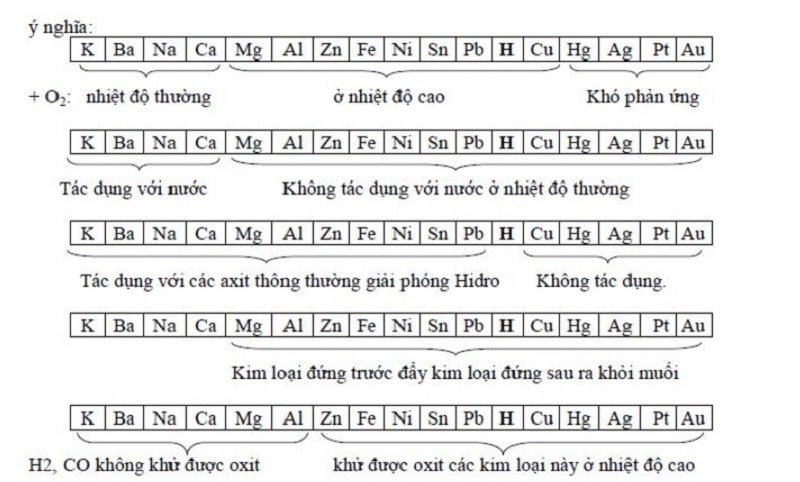
– Kim loại: Đứng trước H trong dãy hoạt động hóa học của kim loại:
Dãy điện hoá kim loại:
K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
Cách nhớ: Khi Nào Cần Mua Áo Záp Sắt Nhìn Sang Phải Hỏi Cửa Hàng Á Pi Âu
Ví dụ: 2Na + 2HCl = 2NaCl + H2↑
Mg + H2SO4 (loãng) = MgSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2↑
– Chú ý: Sắt khi Tác dụng với HCl, H2SO4 loãng chỉ tạo muối sắt (II) chứ không tạo muối sắt (III) (phản ứng không mạnh nên không tạo muối sắt (III), muối sắt (III) tạo ra khi phản ứng với H2SO4 đặc nóng).
Axit Công dụng với bazo
– Axit Tác dụng với bazo tạo thành muối và nước
PTPƯ: Axit + Bazo → Muối + H2O
– Điều kiện: toàn bộ những axit đều Tác dụng với bazơ. Phản ứng xảy ra mãnh liệt và được gọi là phản ứng trung hòa.
Ví dụ: NaOH + HCl → NaCl + H2O
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
Cu(OH)2 + H2SO4 (loãng) → CuSO4 + 2H2O
Axit Tác dụng với Oxit bazơ
– Axit Công dụng với Oxit bazơ tạo thành muối và nước
PTPƯ: Axit + Oxit bazơ → Muối + H2O
– Điều liện: toàn bộ các axit đều Tác dụng với oxit bazơ.
Ví dụ: Na2O + 2HCl = 2NaCl + H2O
FeO + H2SO4(loãng) = FeSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Axit Tác dụng với muối
– Muối (tan) + Axit (mạnh) → Muối mới (tan hoặc không tan) + Axit mới (yếu hoặc dễ bay hơi hoặc mạnh).
– Điều kiện phản ứng:
+ Muối tham gia tan, Axit mạnh, muối tạo thành không tan trong axit sinh ra
+ Chất tạo thành có ít nhất 1 kết tủa (ký hiệu:↓) hoặc một khí bay hơi (ký hiệu: ↑)
+ Sau phản ứng, nếu muối mới là muối tan thì axit mới phải yếu, nếu muối mới là muối không tan thì axit mới phải là axit mạnh.
Ví dụ: H2SO4 + BaCl2 = BaSO4↓ + 2HCl
K2CO3 + 2HCl = 2KCl + H2O + CO2
Lưu ý: (H2CO3 không bền và phân hủy ra H2O và CO2)
Tính chất hoá học của Bazơ
Bazo Công dụng với chất chỉ thị màu
– Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
– Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
Bazo Công dụng với oxit axit
– Dung dịch bazơ Công dụng với oxit axit tạo thành muối và nước.
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
Bazơ Tác dụng với axit
– Bazơ (tan và không tan) Tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
Bazơ Tác dụng với muối
– Dung dịch bazơ Tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Bazơ phản ứng phân huỷ
– Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Tính chất hóa học của muối
Tác dụng với kim khí
+ Dung dịch muối có khả năng Công dụng với kim loại tạo thành muối mới và kim khí mới.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Tác dụng với axit
+ Muối có khả năng Công dụng được với axit tạo thành muối mới và axit mới.
Ví dụ: BaCl2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Tác dụng với dung dịch muối
+ Hai dung dịch muối có thể Tác dụng với nhau tạo thành hai muối mới.
Ví dụ: AgNO3 + NaCl → NaNO3 + AgCl↓
Tác dụng với dung dịch bazơ
+ Dung dịch bazơ có thể Tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
Phản ứng phân hủy muối
+ Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Phản ứng trao đổi trong dung dịch
Định nghĩa
+ Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhay các thành phần cấu tạo của chúng để tạo ra các hợp chất mới.
Điều kiện xảy ra phản ứng trao đổi
+ Phản ứng trao đổi trong dung dịch của các chất chỉ diễn ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ví dụ: CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Phản ứng không diễn ra.
Lưu ý: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn diễn ra.
Ví dụ: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Như vậy, Kovacova đã giải đáp cho bạn về Tính chất hóa học của oxit axit bazơ muối. Hy vọng với những chia sẻ trong bài viết này sẽ giúp bạn có thêm những thông tin hữu ích cho mình nhé!
Xem thêm: Tính chất hóa học của halogen