Tính chất hóa học của Halogen? Nếu bạn đang thắc mắc về tính chất hóa học của hợp chất hóa học này thì bài viết này chính là dành cho bạn.
Dưới đây, Kovacova sẽ cùng bạn giải đáp về vấn đề này nhé!
Tính chất hóa học của Halogen
Các Halogen có tính oxi hóa mạnh
- Những halogen có tính oxi hóa mạnh và thực tế cho thấy chúng dễ dàng kết liên ion với những kim khí và oxi hóa những kim loại đến hóa trị cao nhất.
- Các halogen biểu hiện các chừng độ oxi hóa khác nhau rõ rệt khi đi từ flo đến iot, mỗi halogen đứng sau nó ra khỏi dung dịch muối halogen.
- Tính oxi hóa giảm dần từ flo đến iot.
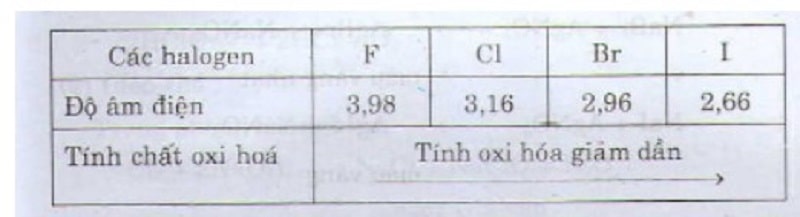
- So sánh tính chất hóa học của halogen.
- Nhận mặt những ion F– , Cl– , Br– , I–
Dùng AgNO3 làm thuốc thử:
NaF + AgNO3 → không Công dụng
NaCl + AgNO3 → AgCl↓ + NaNO3 (kết tủa màu trắng)
NaBr + AgNO3 → AgBr ↓ + NaNO3 (kết tủa màu vàng nhạt)
NaI + AgNO3 → AgI↓ + NaNO3 (kết tủa màu vàng)
Tính chất hóa học của Halogen
Halogen Tác dụng với kim khí
Những halogen phản ứng với hầu hết những kim khí trừ Au và Pt (riêng F2 phản ứng được với tất cả những kim loại) → muối halogenua. các phản ứng thường xảy ra ở nhiệt độ cao.
2M + nX2 → 2MXn
Muối thu được thường ứng với mức hóa trị cao nhất của kim loại. Riêng phản ứng của Fe với I2 chỉ tạo sản phẩm là FeI2.

Tính chất hóa học của Halogen
Halogen phản ứng với hiđro tạo thành hiđro halogenua
H2 + X2 → 2HX
Những halogen tham gia phản ứng cộng H2 với điều kiện khác nhau:
+ F2: phản ứng được ngay cả trong bóng tối.
+ Cl2: phản ứng khi được chiếu sáng.
+ Br2: phản ứng diễn ra khi được đun nóng ở nhiệt độ cao.
+ I2: phản ứng có tính thuận nghịch và phải được đun nóng.
– Điều kiện phản ứng với H2 phức tạp dần khi đi từ F2 đến I2 nên phản ứng với H2 có khả năng làm rõ tính oxi hóa trong nhóm halogen giảm dần từ F2 đến I2.
Halogen Công dụng với nước
– F2 Tác dụng mãnh liệt với nước:
2H2O + 2F2 → 4HF + O2
⇒ Phản ứng chứng tỏ F2 có tính oxi hóa mạnh hơn của O2.
– Br2 và Cl2 có phản ứng thuận nghịch với nước:
H2O + X2 ⇔ HX + HXO (axit halogen hiđric và axit hipohalogenơ)
H2O + Cl2 ⇔ HCl + HClO
– Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO → HCl + O. Vì HClO có chứa ion ClO– có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc khử trùng.
– I2 không phản ứng với nước.
Halogen phản ứng với dung dịch kiềm
– Nếu dung dịch kiềm loãng nguội:
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
→ (nước Javen)
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
→ (clorua vôi)
Riêng F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
– Nếu dung dịch kiềm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH → 3 + 3H2O (nhiệt độ 100)
Tác dụng với dung dịch muối halogenua của halogen có tính oxi hóa yếu hơn
– Phản ứng dưới đây X’ là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen X.
X2 + 2NaX’ → 2NaX + X’2
– Riêng F2 không có phản ứng trên
– Những cặp oxi hóa – khử của halogen được xếp theo chiều giảm dần tính khử của những ion X–: I2/2I– > Br2/2Br– > Cl2/2Cl–
– Trong nước:
5Cl2 + 6H2O + Br2 → 10HCl + 2HBrO3
Đơn chất halogen có tính oxi hóa mạnh nhất : Flo có tính oxi hóa mạnh nhất
Một số phản ứng khác của Halogen
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Br2 + SO2 + 2H2O → 2HBr + H2SO4
I2 kết hợp với hồ tinh bột → hợp chất màu xanh tím.
* Chú ý: Trong phản ứng với kim khí và với H2, với dung dung dịch muối của những halogen yếu hơn, halogen là chất oxi hóa. Còn trong phản ứng với nước và dung dịch kiềm, các halogen vừa là chất khử, vừa là chất oxi hóa.
Như vậy, Kovacova đã gợi ý cho bạn về Tính chất hóa học của Halogen. Hy vọng với những chia sẻ trong bài viết này sẽ giúp bạn có thêm những thông tin hữu ích vào chất hóa học này nhé!
Xem thêm: Tính chất hóa học của anken