NaCl (Natri clorua) hay còn có tên gọi quen thuộc là muối được biết đến là một loại gia vị dùng trong công việc chế biến thực phẩm hàng ngày của chúng ta. Vậy tính chất hóa học của NaCl là gì? Những thông tin Kovacova chia sẻ bên dưới đây sẽ giúp bạn giải đáp thắc mắc này.
Tính chất hóa học của NaCl [đầy đủ nhất]

Khái niệm của muối(NaCl)
Muối (NaCl) là một hợp chất hóa học có tên gọi là natri clorua, là chất tạo ra độ mặn của đại dương và những chất lỏng ngoại bào của nhiều cơ thể đa bào và cũng chính là thành phần chính trong muối ăn.
Tính chất vật lí của NaCl
- Nhiệt độ nóng chảy là: 800oC và nhiệt độ sôi ở mức 1454°C.
- Muối là dạng tinh thể, không màu; có vị mặn; hoàn toàn trong suốt; dễ tan trong nước.
- Nóng chảy bay hơi rõ rệt.
- NaCl tinh khiết không hút ẩm nhưng do bị lẫn tạp chất nên bị chảy rữa khi có không khí vào.
Tính chất hóa học của NaCl
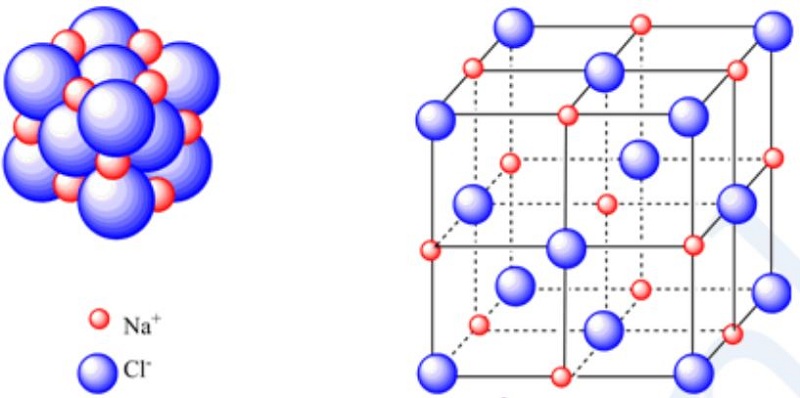
Theo góc độ hóa học, muối là một hợp chất ion vì nó gồm hai ion tích điện trái dấu như natri clorua được cấu tạo thành từ các ion natri (cation) và ion clorua (anion). Các cation và anion có điện tích trái dấu vì vậy chúng bị hút về phía nhau với lực hút tĩnh điện được gọi là liên kết ion. Cùng một số điện tích trái dấu khiến cho các hợp chất ion trung tính không có điện tích.
Vì kim loại là chất điện ly và phi kim loại có độ âm điện trong tự nhiên vì vậy sự kết hợp giữa kim loại và phi kim loại tạo thành các hợp chất ion. Cả hai loại ion được sắp xếp theo thứ tự nhất định để tạo thành mạng tinh thể.
Chúng ta biết rằng cation được hình thành nên do mất electron từ một nguyên tử. Các nguyên tử có xu hướng có được cấu hình octet để có sự ổn định và vì vậy chúng có thể mất hoặc thu được các điện tử. Ở đây thu được các electron tạo thành anion với điện tích âm.
Natri clorua được tạo với các ion natri và ion clorua.
Nguyên tử natri có một electron trong vỏ hóa trị của nó vì thế nó có xu hướng mất electron đó để có được sự ổn định. Tương tự nguyên tử clo có bảy electron trong vỏ hóa trị của nó và có xu hướng thu được một electron để có được sự ổn định. Do vậy nguyên tử clo tạo thành ion clorua (anion) và nguyên tử natri tạo nên ion natri (cation). Cả hai ion tích điện trái dấu đều thu hút tĩnh điện để tạo thành natri clorua.
Một điều nữa trong tính chất hóa học của muối mà bạn cần biết đó là: Do sự hiện diện của các ion, muối là chất ion có trong tự nhiên. Lực hút tĩnh điện mạnh đòi hỏi năng lượng cao để tách các ion khiến tăng điểm nóng chảy và sôi của các hợp chất ion. Các hợp chất ion đã ra lệnh sắp xếp các ion để tạo nên cấu trúc tinh thể hoặc mạng tinh thể. Đây chính xác là lý do tại sao chúng ta có được tinh thể muối trên khoai tây chiên.
Các muối là chất rắn kết tinh, cứng và giòn. Do sự hiện diện của các ion, chúng là chất dẫn nhiệt và điện tốt ở trạng thái nóng chảy và trong các dung dịch. Nhưng chúng là chất cách điện ở trạng thái rắn vì các ion không tự do di chuyển. Dung dịch của các hợp chất ion chính là chất điện phân.Muối là hợp chất ion do đó chúng cho thấy các phản ứng ion xảy ra nhanh chóng và thường tỏa nhiệt trong tự nhiên. Muối không trải qua quá trình đốt cháy nhưng điện phân muối sẽ giải phóng kim loại và phi kim loại như điện phân NaCl nóng chảy tạo thành khí clo và natri kim loại.
2NaCl(l)→2Na(l)+Cl2(g)
Phản ứng của muối với axit chính là phản ứng chuyển vị kép như natri clorua phản ứng với axit sunfuric tạo thành natri sunfat và hydro clorua.
2NaCl(s)+H2SO4(l)→Na2SO4(s)+2HCl(g)
Tương tự dung dịch natri clorua khi phản ứng với dung dịch bạc nitrat và tạo thành bạc clorua.
NaCl(aq)+AgNO3(aq)→NaNO3(aq)+AgCl(s) .
Điều chế muối
Trong phòng thí nghiệm:
- Cho Axit tác dụng với bazơ:
![]()
- Cho sục khí clo vào dung dịch kiềm:
![]()
- Cho Clo đẩy brom và iot khỏi muối bromua và iotua
![]()
- Tiến hành thủy phân hợp chất chứa oxy kém bền với nhiệt như NaClO3
![]()
- Tiến hành đun nhẹ hỗn hợp bão hòa NH4Cl và NaNO2
![]()
Trong công nghiệp:
(1) Khai thác muối từ mỏ muối bằng phương pháp ngầm (qua các lỗ khoan dùng nước hòa tan muối ngầm; bơm dung dịch lên để kết tinh ra muối ăn).
(2) Hoặc cô đặc nước biển bằng cách đun nóng hoặc phơi nắng để kết tinh.
(3) Sục khí HCl vào dung dịch bão hòa muối ăn để tinh chế ra NaCl tinh khiết.
Trạng thái tự nhiên:
– Là hợp chất phổ biến của Na trong tự nhiên.
– Trong nước biển (khoảng 3%); nước hồ; trong khoáng vật halit (muối mỏ).
Ứng dụng:
– Dùng làm lăng kính trong một số dụng cụ quang học.
– Dùng để làm thức ăn.
– Là nguyên liệu dùng để điều chế Na; Cl2; HCl; NaOH… và nhiều hợp chất của natri khác.
– Dùng trong ngành công nghiệp như: thực phẩm; nhuộm; thuộc da; luyện kim..
Vậy là Kovacova đã cung cấp cho bạn các biết về tính chất hóa học của NaCl. Hy vọng với những kiến thức trong bài viết này sẽ giúp bạn có đầy đủ các kiến thức mà bạn đang tìm kiếm! Chúc bạn học tập tốt!