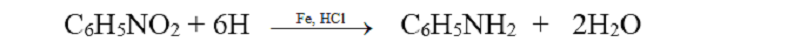Các Amin khác nhau thể hiện tính chất hóa học khác nhau, tính baze của Amin có độ mạnh yếu khác nhau tùy thuộc vào vị trí của Nitơ gắn với gốc hidrocacbon đẩy e hay hút e, gốc không no hay gốc thơm. Để hiếu rõ được tính chất hóa học của amin cũng như tính chất vật lí, ứng dụng và điều chế mời các bạn cùng tham khảu bào đọc dưới đây của Kovacova !
Tính chất hóa học của Amin [Đầy đủ nhất]
Khái niệm và phân loại về Amin
Khái niệm
Khi thay một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon ta được amin.
Ví dụ:
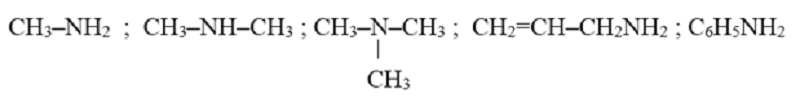
Phân loại
- Theo gốc hiđrocacbon:
Amin không thơm: CH3NH2, C2H5NH2, …
Amin thơm: C6H5NH2, CH3C6H4NH2, …
Amin dị vòng:

- Theo bậc amin: số nguyên tử H trong phân tử NH3 được thay thế bởi gốc hiđrocacbon. Theo đó, các amin sẽ được phân loại thành:
Amin bậc I: R-NH2
Amin bậc II: R-NH-R’
Amin bậc III: 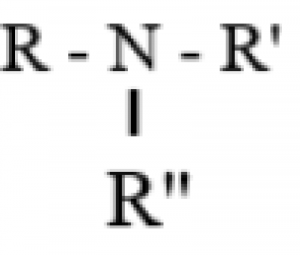
Trong đó: R,R’,R” là gốc hiđrocacbon
Ví dụ:
![]()
Cách gọi tên Amin – Danh pháp
- Cách gọi tên theo danh pháp gốc – chức:
Tên amin = Gốc hiđrocacbon + amin
Ví dụ:
CH3NH2 (Metylamin), C2H5–NH2 (Etylamin)
- Cách gọi tên theo danh pháp thay thế :
Tên amin = Tên của hiđrocacbon tương ứng + Số thứ tự của C chứa nhóm NH + amin
Ví dụ:
CH3NH2 (Metanamin), C2H5–NH2 (Etanamin)
- Tên thông thường chỉ áp dụng với một số amin
Ví dụ: C6H5NH2: anilin
Tính chất vật lý
Amin là Chất rắn, dạng tinh thể, không màu, vị hơi ngọt. Nhiệt độ nóng chảy cao, dễ dàng tan trong nước vì amino axit tồn tại ở dạng ion lưỡng cực: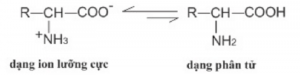
Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn. Anilin là chất lỏng, nhiệt độ sôi là 184oC, không màu, cực độc, tan ít trong nước, dễ tan trong ancol và benzen.
Cấu tạo phân tử
Trong phân tử Amin đều có nguyên tử Nitơ còn một cặp electron tự do chưa liên kết có thể tạo cho – nhận giống NH3. Vậy nên các amin có tính bazơ giống NH3 (tức tính bazơ của amin tương đương tính bazơ của NH3).
R-NH2
Tính chất hoá học
Tính bazơ
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng khiến có khả năng nhận proton.
- So sánh tính bazơ của các amin:
Nếu nguyên tử N trong phân tử Amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của Amin sẽ mạnh hơn tính bazơ của NH3. Những Amin này sẽ làm cho quỳ tím thành màu xanh.
Nếu nguyên tử N trong phân tử Amin được gắn với gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin sẽ yếu hơn tính bazơ của NH3. Những amin này sẽ không làm xanh quỳ tím.
Nếu Amin có càng nhiều gốc đẩy e thì tính bazơ sẽ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1–NH2 > H–NH2 > C6H5–NH2
– Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
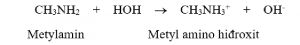
Amin bậc III mà gốc hiđrocacbon R, R’ và R’’ có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+ làm cho tính bazơ yếu dẫn đến dung dịch không làm đổi màu quỳ tím và phenolphtalein.
– Anilin và các amin thơm thường rất ít tan trong nước. Dung dịch của chúng không làm đổ màu quỳ tím và phenolphtalein.
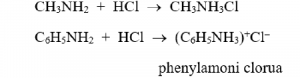
– Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
- Amin tác dụng với dung dịch muối tạo bazơ không tan
Ví dụ:
2CH3NH2 + MgCl2 + 2H2O → Mg(OH)2 + 2CH3NH3Cl
Phản ứng nhận biết bậc của amin
Nếu là amin bậc I khi phản ứng với HNO sẽ tạo khí thoát ra:
RNH2 + HN2O → ROH + N2 + H2O
– Anilin phản ứng tạo muối điazoni ở 0 đến 5oC
C5H6NH2 + HNO2 → C5H6N2 + Cl + 2H2O
– Nếu là amin bậc II thì tạo hợp chất nitrozo màu vàng dễ nổi trên mặt nước:
RNHR’ + HNO2 → RN(NO)R’ + H2O
– Với Amin bậc III thì không có phản ứng này.
Phản ứng nâng bậc amin
RNH2 + R’I → RNHR’ + HI
RNHR’ + R’’I → RNR’R’’ + HI
Phản ứng riêng của Anilin
– Anilin là amin thơm nên không làm xanh quỳ tím .
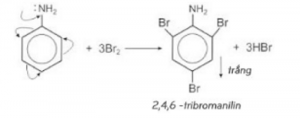
– Anilin tạo ra kết tủa trắng khi tác dụng với dung dịch nước Brom:
Ứng dụng
Các ankylamin thường được dùng trong tổng hợp hữu cơ, nhất là các điamin được dùng để tổng hợp polime.
Anilin là nguyên liệu cần thiết trong công nghiệp phẩm nhuộm (phẩm azo, đen anilin,…), polime (nhựa anilin – fomanđehit,…), dược phẩm (streptoxit, suafaguaniđin,…)
Điều chế
Thay thế nguyên tử H của phân tử amoniac bằng cách:
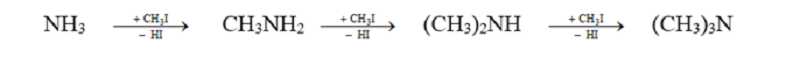
Khử hợp chất nitro